In Deutschland werden jedes Jahr 1,5 Milliarden in die Forschung im Bereich Humanmedizin und Gesundheitswissenschaften investiert.1 Ein Großteil dieser Gelder gehen in die Forschung spezifischer Krankheiten ein, wie beispielsweise Alzheimer-Demenz oder Krebs.
Aber ist das Geld in der Forschung zu spezifischen Alterskrankheiten am sinnvollsten angelegt? Wie viel bringt diese Forschung, wenn sie erfolgreich ist? Wie viel an (gesunder) Lebensdauer wird gewonnen, sobald man gegen eine der chronischen Krankheiten eine Behandlung entwickelt hat?
Chronische Krankheiten im Alter
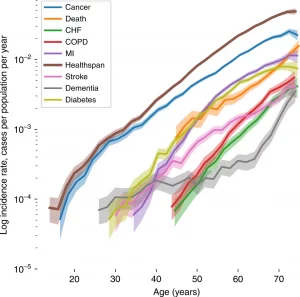
Krankheitshäufigkeit der häufigsten chronischen Erkrankungen abhängig vom Alter2
Die abgebildete Statistik aus einer Studie, die man in Nature nachlesen kann, zeigt, dass die Krankheitshäufigkeit der abgebildeten chronischen Krankheiten ab dem zwanzigsten Lebensjahr exponentiell steigt. Denn was zunächst wie ein linearer Graph wirkt, ist ein exponentieller, wenn man sich die Beschriftung der y-Achse genauer ansieht. Um das zu verdeutlichen: Mit 70 an einer der dargestellten chronischen Krankheiten zu erkranken ist tausendfach wahrscheinlicher als mit 20.
Bei der Studie wurden Teilnehmer, die mehr als eine Krankheit hatten, für jede Krankheit gezählt. Hat ein Teilnehmer beispielsweise Krebs und COPD, so zählte er einmal als Krankheitsauftreten bei Krebs mit in die Statistik und einmal als Krankheitsauftreten bei COPD.
Exponentieller Anstieg der Erkrankungswahrscheinlichkeit mit dem Alter
Die Wahrscheinlichkeit, an den untersuchten chronischen Krankheiten zu erkranken, steigt bei jeder der untersuchten Krankheiten exponentiell. Das bedeutet, dass es ab einem gewissen Alter sehr wahrscheinlich ist, an diesen zu erkranken. Und dass es nur ein Jahr später sehr viel wahrscheinlicher ist als ein Jahr zuvor. Und so weiter.
Was das auch bedeutet: Wenn man ab einem gewissen Alter an einer der chronischen Krankheiten erkrankt, beispielsweise an Krebs, und es tatsächlich durch eine erfolgreiche Krebsbehandlung schafft, den Krebs loszuwerden, erwartet einen kurz darauf sehr wahrscheinlich bereits die nächste chronische Krankheit, beispielsweise Diabetes. Dies liegt daran, wie gerade ausgeführt, dass mit erhöhtem Alter die Wahrscheinlichkeit immens hoch ist, an den genannten chronischen Krankheiten zu erkranken.
Das bedeutet, dass die Lebensspanne durch die Behandlung einer einzigen chronischen Krankheit nicht stark ansteigen wird.
Das ist der Grund, warum die derzeitigen Lösungen, die sich ausschließlich auf die Heilung einzelner Krankheiten konzentrieren, sowohl teuer als auch sehr ineffizient sind, wenn wir bei unserem Ansinnen, länger in Gesundheit zu leben, Fortschritte erzielen wollen. Wir brauchen eine Medizin, die alle Hürden [Anm.: „Hürden im Sinne von Alterskrankheiten/chronische Krankheiten] beseitigt.
David Sinclair, „Das Ende des Alterns“, S. 122
Das Ende der Gesundheitsspanne
Eine der Linien (Healthspan) repräsentiert keine Krankheit, sondern das Alter, ab dem die erste Krankheit beginnt – also der Zeitpunkt, ab dem die Gesundheitsspanne endet. Der Anfangspunkt der chronischen Erkrankung eines Menschen. Interessant ist, dass die Gesundheitsspanne bei den meisten mit einer Krebserkrankung, einem Myokardinfarkt oder Diabetes endet, und nur in sehr seltenen Fällen mit dem Tod. Das heißt, dass die meisten Menschen eine Phase in ihrem Leben haben, in der sie chronisch krank sind, bevor sie sterben.
|
Clinical data |
Interview data |
Combined data |
||||
|---|---|---|---|---|---|---|
|
Events |
% |
Events |
% |
Events |
% |
|
|
Cancer |
66,214 |
51.4 |
41,485 |
48.6 |
74,172 |
51.3 |
|
Diabetes |
20,019 |
15.5 |
23,134 |
27.1 |
26,026 |
18.0 |
|
MI |
25,649 |
19.9 |
10,150 |
11.9 |
24,751 |
17.1 |
|
Stroke |
4731 |
3.7 |
6070 |
7.1 |
6902 |
4.8 |
|
COPD |
6211 |
4.8 |
1484 |
1.7 |
5881 |
4.1 |
|
Dementia |
769 |
0.6 |
2889 |
3.4 |
2706 |
1.9 |
|
Death |
2411 |
1.9 |
0 |
0.0 |
2399 |
1.7 |
|
CHF |
2850 |
2.2 |
231 |
0.3 |
1883 |
1.3 |
Die Tabelle zeigt für die 300.447 Teilnehmer der Studie, durch welche Vorfälle ihre Gesundheitsspanne beendet wurde. Am häufigsten sind Krebs und Diabetes. Nur in weniger als 2% aller Fälle beendete der Tod die Gesundheitsspanne.2
Verlängerung der Krankheitsspanne
Gerade haben wir erläutert: Für eine chronische Krankheit eine Behandlung entwickelt zu haben und durchzuführen bringt nicht viel an (gesunder) Lebenszeit. Meist lebt die Person dann nur wenige Jahre länger (gesund) als wenn sie nicht behandelt worden wäre. Doch diese hinzugewonnenen Jahre werden meist nicht in Gesundheit verbracht, sondern in Krankheit – eine der anderen Krankheiten, die noch nicht behandelt wurden. Dies liegt, wie oben bereits erläutert, daran, dass im hohen Alter für jede der aufgeführten chronischen Erkrankungen die Wahrscheinlichkeit um ein Vielfaches höher ist, daran zu erkranken, als in jüngerem Alter. Nur in der Behandlung einer einzelnen chronischen Erkrankung erfolgreich zu sein, bringt also vergleichsweise wenig mehr an Lebensqualität.
Wir haben die Mortalität stärker vermindert als die Morbidität.
Eileen Crimmins3
Die häufigsten chronischen Krankheiten – das Alter als Risikofaktor
Laut einer Studie werden bei 85-jährigen Männern durchschnittlich vier verschiedene Krankheiten diagnostiziert, bei Frauen sogar fünf.4 Es sind „unterschiedliche Krankheiten mit unterschiedlichen Krankheitsmechanismen. (…) Aber für alle ist das Alter ein Risikofaktor. Es ist sogar der Risikofaktor.“5
Alles in allem ist es deshalb nicht sinnvoll, ausschließlich an der Behandlung einzelner Alterskrankheiten zu forschen. Aber was wäre eine sinnvolle Ergänzung?
Verjüngungsforschung, der Reparaturansatz und die Informationstheorie des Alterns
Vermutlich braucht es zusätzlich zur Forschung an Behandlungen gegen Alterskrankheiten einen weiteren Forschungszweig: die sogenannte Verjüngungsforschung, zu der unter anderem zwei grundlegende Ansätze gehören:
Der Reparaturansatz: Altern als das Anhäufen von Schäden, die beseitigt werden können

Reparaturansatz: Ursachen des Alterns nach Aubrey de Grey: Schadenskategorien und Therapieansätze
Beim Reparaturansatz wird das Altern als das Anhäufen von verschiedenen Schäden interpretiert, die sich in 7 Kategorien einteilen lassen. Die Schäden innerhalb einer Kategorie sind ähnlich geartet, sodass gegen sie mit der gleichen Art der Therapie vorgegangen werden kann.
Der Reparatursansatz ändert den Fokus. Während man bei der Forschung für Behandlungen gegen Alterskrankheiten sich oftmals darin verliert, Behandlungen gegen die Symptome zu entwickeln oder sich in komplexen Stoffwechselwegen verirrt, lenkt der Reparaturansatz den Fokus auf etwas anderes: die Ebene der Schäden. Für den Reparaturansatz muss man also nicht genau verstehen, wie Alterskrankheiten auf molekularer Ebene entstehen oder wie man gegen die Symptome vorgehen kann. Man muss lediglich die 7 Schäden insoweit verstehen, dass man effektive Therapien gegen sie entwickeln kann. Entwickelt man Therapien gegen jede Schadenskategorie – so die These – kommt es erst gar nicht zu den Alterskrankheiten, die wir heute kennen.
Die Informationstheorie des Alterns: Zellen epigenetisch reprogrammieren
Macht Verjüngungsforschung die Forschung für Behandlungen gegen Alterskrankheiten unnötig?
Nein! Zwischen der Forschung an Alterskrankheiten und der Verjüngungsforschung gibt es große Schnittmengen. Beide Herangehensweisen können voneinander profitieren. Wichtig ist jedoch, anzuerkennen, dass der Ansatz, an Alterskrankheiten zu forschen, nicht ausreicht. Und dass Verjüngungsforschung ein vielversprechender Ansatz ist, dessen Finanzierung aktuell noch nicht seinem Potenzial für die Gesundheit und Langlebigkeit gerecht wird.
Quellen
- Statistisches Bundesamt. (n.d.). Ausgaben, Einnahmen und Personal der öffentlichen und öffentlich geförderten Einrichtungen für Wissenschaft, Forschung und Entwicklung – Fachserie 14 Reihe 3.6 – 2020 (Letzte Ausgabe – berichtsweise eingestellt). [online] Available at: https://www.destatis.de/DE/Themen/Gesellschaft-Umwelt/Bildung-Forschung-Kultur/Forschung-Entwicklung/Publikationen/Downloads-Forschung-Entwicklung/ausgaben-einnahmen-personal-2140360207004.pdf?__blob=publicationFileAusgaben [Accessed 26 Apr. 2024].
- Zenin, A., Tsepilov, Y., Sharapov, S., Getmantsev, E., Menshikov, L.I., Fedichev, P.O. and Aulchenko, Y. (2019). Identification of 12 genetic loci associated with human healthspan. Communications Biology, [online] 2(1). doi:https://doi.org/10.1038/s42003-019-0290-0.
- Crimmins, E.M. (2015). Lifespan and Healthspan: Past, Present, and Promise. The Gerontologist, [online] 55(6), pp.901–911. doi:https://doi.org/10.1093/geront/gnv130.
- Collerton, J., Davies, K., Jagger, C., Kingston, A., Bond, J., Eccles, M.P., Robinson, L.A., Martin-Ruiz, C., von Zglinicki, T., James, O.F.W. and Kirkwood, T.B.L. (2009). Health and disease in 85 year olds: baseline findings from the Newcastle 85+ cohort study. BMJ, [online] 339(dec22 1), pp.b4904–b4904. doi:https://doi.org/10.1136/bmj.b4904.
- Sinclair, D.A. and LaPlante, M.D. (2019). Das Ende des Alterns. Dumont Buchverlag, p.124.
Verfasser: Sandra
